LIỆU PHÁP VẮC XIN UNG THƯ
Vắc-xin ung thư tự thân có nguồn gốc từ các mảnh mô chiết xuất từ khối u và chất kích thích miễn dịch (immunoadjuvants) của chính bệnh nhân.
Immunoadjuvants: một chất không đặc hiệu có tác dụng tăng cường đáp ứng miễn dịch đối với kháng nguyên được sử dụng.
AFTVac (Vắc-xin tự thân ngừa khối u cố định bằng formalin) là gì?
Một loại vắc-xin ngừa khối u độc đáo
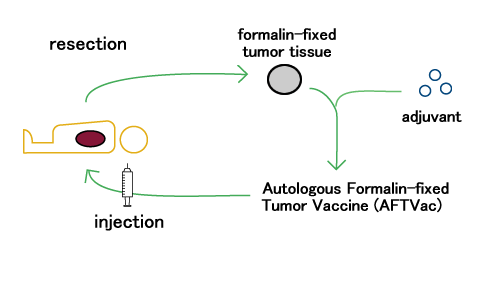
Đây là một loại vắc-xin ung thư mới và sáng tạo bao gồm các mảnh mô cố định bằng formaldehyd (còn gọi là formalin) hoặc nhúng vào sáp (parafin) có nguồn gốc từ chính bệnh nhân (từ khối u) và thuốc tăng cường miễn dịch. Đây là một trong những loại vắc-xin tự thân (vắc-xin tự động hoặc vắc-xin ung thư tự ghép), không có bất kỳ tác dụng phụ có vấn đề nào.
AFTVac là một loại thuốc được sản xuất riêng cho từng bệnh nhân để chống lại ung thư
AFTVac được tiêm vào bệnh nhân đã được phẫu thuật cắt bỏ mô ung thư.
AFTVac chứa tất cả các kháng nguyên liên quan đến ung thư dành riêng cho mỗi bệnh nhân cụ thể. Các tế bào miễn dịch ở bệnh nhân đó sẽ phân biệt giữa các tế bào ung thư và các tế bào bình thường sau khi tiêm AFTVac (hai tuần một lần trong tổng số 3 lần tiêm trên cơ sở bệnh nhân ngoại trú).
Vắc-xin có khả năng ngăn chặn sự tái phát, ngăn ngừa sự di căn và điều trị các tế bào ung thư còn sót lại của nhiều loại ung thư ở người sau phẫu thuật cắt bỏ.
Nền tảng nghiên cứu và phát triển
Vắc-xin khối u nhằm tăng cường đáp ứng miễn dịch tế bào được báo cáo cho đến nay bao gồm các tế bào khối u đã chiếu xạ, 1-5 sản phẩm phân giải tế bào ung thư1 được tiêm cùng với tá dược,6, 7 tế bào khối u biến đổi gen,8, 9 peptide kháng nguyên liên quan đến khối u,10 peptide các tế bào đuôi gai được nạp,11 hoặc các tế bào đuôi gai hợp nhất với các tế bào khối u.12, 13 Trong số các vắc-xin khối u, peptide kháng nguyên liên quan đến khối u, không may, chỉ có hiệu quả đối với các bệnh nhân mang các alen phức hợp tương hợp mô học chính (MHC) (MHC),10 peptide và sản phẩm phân giải tế bào ung thư là những chất gây miễn dịch khá yếu.
Ngược lại, các tế bào đuôi gai được nạp sẵn kháng nguyên về mặt lý thuyết có thể là vắc-xin đầy hứa hẹn11 mặc dù việc xây dựng loại vắc-xin này đòi hỏi các quy trình thử nghiệm phức tạp bao gồm xử lý tế bào sống. Nếu một người lo ngại về việc sử dụng và chấp nhận điều trị trong thực hành lâm sàng, thì sự đơn giản trong kỹ thuật quản lý cũng như trong việc chuẩn bị như xử lý vắc-xin sát sao là những yếu tố chính. Về mặt này, vắc-xin DNA rất đơn giản, nhưng thật không may, đôi khi không cung cấp đủ lượng kháng nguyên.14
Sau khi tiêm vắc-xin khối u, các nhà khoa học hy vọng sẽ tạo ra tế bào lympho T gây độc (CTL) để nhận biết và tiêu diệt các tế bào khối u nhắm mục tiêu theo cách rất cụ thể. Người ta đã xác nhận và chấp nhận rằng CTL gây độc tế bào nhiều hơn nhiều so với tế bào tiêu diệt được hoạt hoá lymphokine (LAK) chống lại ung thư.15-24
Trong các thử nghiệm trên động vật, nhiều phòng thí nghiệm đã chỉ ra rằng CTL là các tế bào tác nhân chính để ngăn chặn sự hình thành mô ung thư thử nghiệm trên các dòng tế bào khối u có thể ghép được với di căn của chúng và để chữa các khối u đã thành lập.
Chúng tôi cũng như những nhà nghiên cứu khác đã xác nhận tính hiệu quả của CTL tự thân gây ra trong ống nghiệm ở những bệnh nhân chứa u thần kinh ác tính tái phát.25 Ngoài ra, chúng tôi thấy rằng các mô khối u não mới bị cắt bỏ và chia nhỏ có thể là mục tiêu hữu ích để tạo ra CTL tự thân từ tế bào đơn nhân máu ngoại vi (PBMC).26
Hơn nữa, người ta đã chỉ ra rằng các phần mô (của khối u) nhúng paraffin đã cố định formalin (FFPE) được áp dụng như là nguồn tạo nên kháng nguyên khối u,27, 28 và các tế bào ung thư nuôi cấy cố định có thể kích thích sự nhân lên của CTL tự thân. Các báo cáo đã chỉ ra CTL ở người được tạo ra trên các tế bào máu kết dính cố định được nạp trước đó với kháng nguyên khối u.30, 31
Liên quan đến tác động trong thực hành lâm sàng, sự đơn giản trong việc chuẩn bị và xử lý của vắc-xin ung thư là một yếu tố quan trọng. Về mặt này, vắc-xin bao gồm các tế bào sống trong công thức là bất lợi vì các kỹ thuật chuẩn bị phức tạp.
AFTVac đã được phát minh như một loại vắc-xin khối u tự thân mới, đơn giản, ổn định và hiệu quả lâm sàng dựa trên những kiến thức khoa học này.
Tài liệu tham khảo
Báo cáo
2012 – Báo cáo: Vắc-xin khối u tự thân đã ngăn chặn tái phát ung thư tế bào gan liên quan đến viêm gan C sau 29 lần điều trị không thành công với liệu pháp thông thường (xem tại đây).
Tham khảo
- Berd, D., Maguire, H.C., Jr., and Mastrangelo, M.J. Induction of cell-mediated immunity to autologous melanoma cells and regression of metastases after treatment with a melanoma cell vaccine preceded by cyclophosphamide. Cancer Res. 46: 2572-2577, 1986.
- Berd, D., Maguire, H.C., Jr., McCue, P. and Mastrangelo, M.J. Treatment of metastatic melanoma with an autologous tumor-cell vaccine: Clinical and immunologic results in 64 patients. J. Clin. Oncol., 8: 1858-1867, 1990.
- Livingston, P.O., Albino, A.P., Chung, T.J., Real, F.X., Houghton, A.N., Oettgen, H.F. and Old, L.J. Serological response of melanoma patients to vaccines prepared from VSV lysates of autologous and allogeneic cultured melanoma cells. Cancer, 55: 713-720, 1985.
- McCune, C.S., O’Donnell, R.W., Marquis, D.M. and Sahasrabudhe, D.M. Renal cell carcinoma treated by vaccines for active specific immunotherapy: correlation of survival with skin testing by autologous tumor cells. Cancer. Immunol. Immunother. 32: 62-66, 1990.
- Soiffer, R., Lynch, T., Mihm, M., Jung, K., Rhuda, C., Schmollinger, J.C, Hodi, F.S., Liebster, L., Lam, P., Mentzer, S., Singer, S., Tanabe, K.K., Cosimi, A.B., Duda, R., Sober, A., Bhan, A., Daley, J., Neuberg, D., Parry, G., Rokovich, J., Richards, L., Drayer, J., Berns, A., Clift, S., Cohen, L.K., Mulligan, R.C. and Dranoff. G. Vaccination with irradiated autologous melanoma cells engineered to secrete human granulocyte-macrophage colony-stimulating factor generates potent antitumor immunity in patients with metastatic melanoma. Proc. Natl. Acad. Sci. USA 95: 13141-13146, 1998.
- Johnston, D. and Bystryn, J.C. Effect of cell wall skeleton and monophosphoryl lipid A adjuvant on the immunogenicity of a murine B16 melanoma vaccine. J. Natl. Cancer. Inst. 83: 1240-1245, 1991.
- Powles, R.L., Russell, J.A., Selby, P.J., Prentice, H.G., Jones, D.R., McElwain, T.J. and Alexander, P. Maintenance of remission in acute myelogenous leukaemia by a mixture of B.C.G. and irradiated leukaemia cells. Lancet 2: 1107-1110, 1977.
- Coutelle, C., Douar, A.M., Colledge, W.H. and Froster, U. The challenge of fetal gene therapy. Nat. Med. 1: 864-866, 1995.
- Huang, L. and Li, S. Liposomal gene delivery: a complex package. Nat. Biotechnol. 15: 620-621, 1997.
- Protti, M.P. and Bellone, M. Immunotherapy: natural versus synthetic peptides. Immunol. Today 19: 98-98, 1998.
- Mayordomo, J.I., Zorina, T., Storkus, W.J., Zitvogel, L., Celluzzi, C., Falo, L.D., Melief, C.J., Ildstad, S.T., Kast, W.M., Deleo, A.B. and Lotze, M.T. Bone marrow-derived dendritic cells pulsed with synthetic tumour peptides elicit protective and therapeutic antitumour immunity. Nat. Med. 1: 1297-1302, 1995.
- Gong, J., Chen, D., Kashiwaba, M. and Kufe, D. Induction of antitumor activity by immunization with fusions of dendritic and carcinoma cells. Nat. Med. 3: 558-561, 1997.
- Guo, Y., Wu, M., Chen, H., Wang, X., Liu, G., Li, G., Ma, J. and Sy, M. S. Effective tumor vaccine generated by fusion of hepatoma cells with activated B cells. Science 263: 518-520, 1994.
- Pardoll, D.M. Cancer vaccines. Nat. Med. vaccine suppl. 4: 525-531, 1998.
- Fisher, R.I., Coltman, C.A., Jr., Doroshow, J.H., Rayner, A.A., Hawkins, M.J., Mier, J.W., Wiernik, P., McMannis, J.D., Weiss, G.R., Margolin, K.A., Gemlo, B.T., Hoth, D.F., Parkinson, D.R. and Paietta, E. Metastatic renal cancer treated with interleukin-2 and lymphokine-activated killer cells – a phase II clinical trial. Ann. Intern. Med. 108: 518-523, 1988.
- Holladay, F.P., Heitz, T. and Wood, G.W. Antitumor activity against established intracerebral gliomas exhibited by cytotoxic T lymphocytes, but not by lymphokine-activated killer cells. J. Neurosurg. 77: 757-762, 1992.
- Ikarashi, H., Fujita, K., Takakuwa, K., Kodama, S., Tokunaga, A., Takahashi, T. and Tanaka, K. Immunomodulation in patients with epithelial ovarian cancer after adoptive transfer of tumor-infiltrating lymphocytes. Cancer Res. 54: 190-196, 1994.
- Ioannides, C.G. and Whiteside, T. T cell recognition of human tumors: Implications for molecular immunotherapy of cancer. Clin. Immunol. Immunopathol. 66: 91-106, 1993.
- Kawakami, Y., Eliyahu, S., Delgado, C.H., Robbins, P.F., Sakaguchi, K., Appella, E., Yannelli, J.R., Adema, G.J., Miki, T. and Rosenberg, S.A. Identification of a human melanoma antigen recognized by tumor-infiltrating lymphocytes associated with in vivo tumor rejection. Proc. Natl. Acad. Sci. USA 91: 6458-6462, 1994.
- Monaco, J.J. A molecular model of MHC class-I-restricted antigen processing. Immunol. Today 13: 173-179, 1992.
- Rosenberg, S.A., Aebersold, P., Cornetta, K., Kasid, A., Morgan, R.A., Moen, R., Karson, E.M., Lotze, M.T., Yang, J.C., Topalian, S.L., Merino, M.J., Culver, K., Miller, A.D., Blaese, R.M. and Anderson, W.F. Gene transfer into humans-immunotherapy of patients with advanced melanoma, using tumor infiltrating lymphocytes modified by retroviral gene transduction. N. Engl. J. Med. 323: 570-578, 1990.
- Rosenberg, S.A., Lotze, M.T., Muul, L.M., Chang, A.E., Avis, F.P., Leitman, S., Linehan, W.N., Robertson, C.N., Lee, R.E., Rubin, J.T., Seipp, C.A., Simpson, C.G. and White, D.E. A progress report on the treatment of 157 patients with advanced cancer using lymphokine-activated killer cells and interleukin-2 or high-dose interleukin-2 alone. N. Engl. J. Med. 316: 889-897, 1987.
- Slingluff, C.L., Cox, A.L., Stover, J.M.J., Moore, M.M., Hunt, D.F. and Engelhard, V.H. Cytotoxic T-lymphocyte response to autologous human squamous cell cancer of the lung: epitope reconstitution with peptides extracted from HLA-Aw68. Cancer Res. 54: 2731-2737, 1994.
- Tjoa, B.A. and Kranz, D.M. Generation of cytotoxic T-lymphocytes to a self-peptide/class I complex: a model for peptide-mediated tumor rejection. Cancer Res. 54: 204-208, 1994.
- Tsurushima, H., Liu, S.Q., Tuboi, K., Matsumura, A., Yoshii, Y., Nose, T., Saijo, K. and Ohno, T. Reduction of end-stage malignant glioma by injection with autologous cytotoxic T lymphosytes, Jpn. J. Cancer Res. 90: 536-545, 1999.
- Tsurushima, H., Liu, S.Q., Tsuboi, K., Yoshii, Y., Nose, T. and Ohno, T. Induction of human cytotoxic T lymphocytes against minced tissues of glioblastoma multiforme. J. Neurosurg. 84: 258-263, 1996.
- Liu, S.Q., Saijo, K., Todoroki, T. and Ohno, T. Induction of human autologous cytoyoxic T lymphocytes on formalin-fixed and paraffin-embedded tumour sections. Nat. Med. 1: 267-271, 1995.
- Liu, S.Q., Shiraiwa, H., Kawai, K., Hayashi, H., Akaza, H., Kim, B.S., Oki, A., Nishida, M., Kubo, T., Hashizaki, K., Saijo, K. and Ohno, T. Tumor-specific autologous cytotoxic T lymphocytes from tissue section. Nat. Med., 2: 1283-1283, 1996.
- Horiuchi, K., Tsurushima, H., Kim, B.S., Liu, S.Q., Saijo, K., Nukiwa, T., Mastumura, M. and Ohno, T. Expansion of human autologous cytotoxic T lymphocytes on fixed target tumor cells. Cytotechnology 26: 119-124, 1998.
- Kim, C., Matsumura, M., Saijo, K. and Ohno, T. In vitro induction of HLA-A2402-restricted and carcinoembryonic-antigen-specific cytotoxic T lymphocytes on fixed autologous peripheral blood cells. Cancer Immunol. Immunother. 47: 90-96, 1998.
- Kim, C.H., Todoroki, T., Matsumura, M., and Ohno, T. Eligibility of antigenic-peptide pre-loaded and fixed adhesive pripheral blood cells for induction of cytotoxic T lymphocytes fro cancer patients with elevated serum CEA levels. J. Cancer Res. Clin. Oncol. 126: 383-390, 2000.
ĐẶT LỊCH TƯ VẤN VỚI BÁC SĨ – LIỆU PHÁP VẮC-XIN TỰ THÂN ĐIỀU TRỊ UNG THƯ
FUTURE CLINIC
Địa chỉ: 800 Nguyễn Văn Linh, P. Tân Phú, Quận 7, HCM
Hotline: 1900 63 67 16 – 0901 24 77 88





